機能性表示を行うにあたって留意すべき点
- 健康な成人が対象
- 特別用途食品※、栄養機能食品でない
- アルコールを含まない
- 厚生労働省の「食事摂取基準」に基準が定められた栄養素でない (例外あり)
- 「専ら医薬品として使用される成分本質」リストにない
- 脂質、糖類、ナトリウムの過剰摂取にならない
※乳児用食品、介護用食品など
消費者庁 「機能性表示食品の届出等に関するガイドライン」機能性関与成分に関する必要条件
- 機能性関与成分が明らかで、定量できる。またはエキスとして条件を満たしている。
- 作用機序が考察でき、科学的根拠を説明できる。
- 機能性の作用機序が、in vitro試験およびin vivo試験、または臨床試験によって考察されている。
- 最終製品を用いた臨床試験か、最終製品か機能性観葉成分に関する研究レビューで機能性の根拠が説明できる。
- 科学的根拠を主張するためには、臨床試験または観察研究に関わる査読付き論文か、表示しようとする機能を指示する査読付き論文が一報以上必要。
- 安全性の確認ができる。
- 食経験(喫食実績)もしくは安全性試験の結果、安全性が確認できている。
- 医薬品との相互作用、機能性関与成分同士の相互作用で安全性が確認できている。
- 機能性関与成分の同等性の考察ができる。

- パターン解析(クロマトグラフ等)などの分析結果をもとに、届け出る商品の機能性関与成分と文献中の成分が定性的、定量的に同等であることを考察できる。
- 機能性関与成分の量について
- 一日摂取目安量が通常食べられる分量であること。生鮮食料品は有効量の50%以上あればOK。
- 塩分、糖分、飽和脂肪酸、コレステロールの過剰摂取につながる食品は不可。
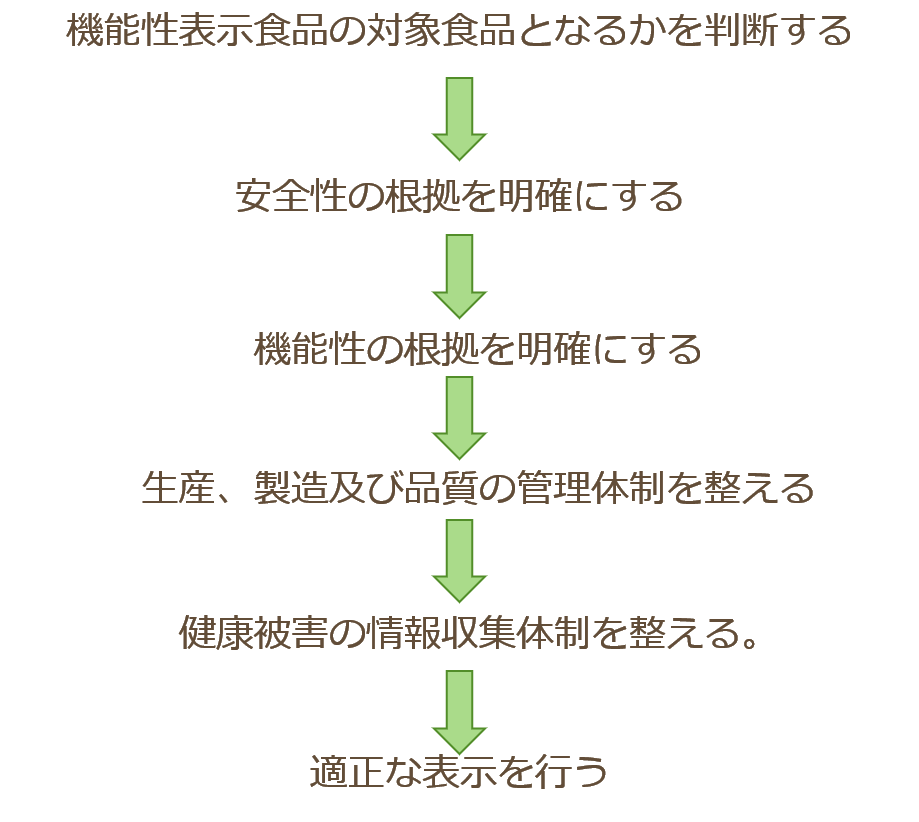
届出手順
- 届出は「機能性表示食品の届出等に関するガイドライン」に従って行います。
- 機能性表示食品は「食品」。安全性に関する確認は重要です。喫食実績(食経験)や文献情報、安全性試験の結果などで評価します。
- 機能性の根拠となる研究レビュー(システマティックレビュー、SR)は届出において非常に重要な書類です。また、最も作成に手間のかかる部分です。
- 機能性表示食品として届出完了するには様々な確認事項や手順があり、一つ一つ確認しながら丁寧に進めていくことが必要です。
研究レビュー(システマティックレビュー、SR)
- 機能性表示食品について、機能性の科学的な根拠を評価する方法としては、最終製品による臨床試験と、文献調査による研究レビュー(システマティックレビュー、SR)があります。臨床試験は実施のハードルがかなり高いため、機能性表示食品の多くは研究レビューの結果を機能性の根拠として届出が行われています。
-
 システマティックレビュー(SR)は、あらかじめ設定した条件で網羅的に論文を抽出し、関与成分に機能性が認められるか総合的に確認を行う方法です。臨床試験よりぐっとハードルは低くなりますが、様式に則ってきちんとしたSRを作成するのには専門的な知識が必要とされます。自社での作成が難しい場合は専門の業者やコンサルタントに依頼することになり、時間と費用のかかる部分です。
システマティックレビュー(SR)は、あらかじめ設定した条件で網羅的に論文を抽出し、関与成分に機能性が認められるか総合的に確認を行う方法です。臨床試験よりぐっとハードルは低くなりますが、様式に則ってきちんとしたSRを作成するのには専門的な知識が必要とされます。自社での作成が難しい場合は専門の業者やコンサルタントに依頼することになり、時間と費用のかかる部分です。 - 条件が合えば農研機構が公開しているSRを利用できる場合もあります。
分析
- 予備データなどは自社や公設試等の分析でもかまわないのですが、消費者庁への届出書類に添付するために最低1回は登録検査機関などでの分析が必要になります。
- 届出書類に添付するのは原則として第三者機関(登録検査機関等:例(一財)日本食品分析センター)で発行した最終製品の分析証明書です※。
※規定の第三者機関で分析が行えない合理的な理由がある場合についてはこの限りではありません。 - ロット、賞味期限、保管状態などによるばらつきを把握するバックデータとして複数回の分析が必要とされますが、最も費用がかさむ部分になるので、慎重に計画を立て無駄のないように行います。
パッケージへの表示
ヘルスクレームの表現、義務表示、定型文、注意事項、成分表示など、チェック事項がたくさんあります。ガイドラインに基づいて、景品表示法、薬機法(旧薬事法)、食品表示法などに抵触しないよう十分気をつけて作成します。生鮮食品と加工食品で異なる部分があることには注意が必要です。
 ※生鮮食品で必要とされる表示の例
※生鮮食品で必要とされる表示の例
